PCO szindróma
A PCOS magyarul policisztás ovárium/petefészek szindrómát jelent és minden tizedik magyar nőt érint. A komplex anyagcsere- és hormonális zavart sajnos igen gyakran csak akkor diagnosztizálják, amikor a páciens gyermeket szeretne – holott a tünetek már korábban is fennálltak, a betegség rövid- és hosszú távú következményei pedig megkeserítik a beteg életét.
A PCOS tünetei
A PCOS legfontosabb tünetei a pattanásos bőr, hajhullás, férfias típusú szőrnövekedés, hízékonyság (különösen deréktájon), rendszertelen vagy hiányzó menzesz.
A hivatalos diagnosztika szerint az alábbi három tünetből kettő megléte elegendő ahhoz, hogy PCOS-ről beszélhessünk:
- Peteérési vagy menstruációs zavar
- Férfihormon-túlsúly tünetei (erőteljes szőrnövekedés, hasi elhízás, megemelkedett tesztoszteron szint)
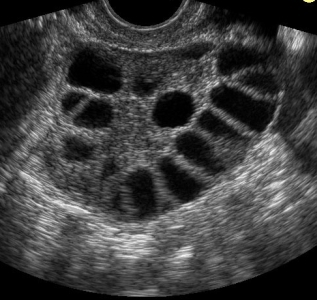
- Policisztás ováriumok észlelése ultrahanggal (mindkét petefészekben 10 mm alatti ciszták)
A petefészkekben a havi ciklusban nem érik meg a tüsző, hanem egy 10 mm-nél kisebb ciszta formájában visszamarad. Bár ez a PCOS szindróma névadó tünete, megléte mégsem kritérium a diagnózisban. A gyöngyfűzér formában elhelyezkedő ciszták ugyanis nem csak erre a betegségre jellemzők – ugyanakkor nem az összes PCOS betegre jellemző a ciszták megléte.
A legtöbb PCO-s nő ugyan szenved ezektől a problémáktól tinédzser korától a menopauzáig, mégsem diagnosztizálják a baját. A tévhittel ellentétben, a vékonyság nem kizáró ok, illetve más hormonális zavarral is együtt járhat, pl. a gyakori pajzsmirigy-alulműködéssel (lelassult anyagcsere, fázósság, száraz bőr stb.)
Sokan a nőgyógyászt keresik fel problémáikkal, ugyanis elsősorban nőgyógyászati panaszokat okoz: a rendetlen ciklus mellett gyakori a pecsételő vérzés, a menzesz elmaradása, vagy görcsös menstruáció. Az ultrahangon gyakran – de nem mindig! – láthatók a petefészkeket beborító apró ciszták. Számos PCO-s fiatal nő azért keresi fel a nőgyógyászt, mert nem sikerül teherbe esnie vagy megtartania a terhességét.
A PCOS okai
A felsoroltak igen fontos tünetek, de a tényleges ok sokszor rejtve marad! Hátterében egyértelműen komplex anyagcserezavarra való hajlam, INZULINREZISZTENCIA áll. Ez egy cukorbetegséget (diabéteszt) megelőző állapot.
A tényleges terápia ennek az anyagcserezavarnak a kezelése! A ciklus rendezhető, sokszor sikeresen indukálható a peteérés, spontán terhesség várható, a bőrpanaszok megszűnnek. Az esetek nagy részében elkerülhető a meddőségi beavatkozás.
A PCOS kivizsgálása
A PCOS kivizsgálása igen bonyolult és sokrétű feladat, mert a tünetek és panaszok igen sokrétűek, a hormonzavar csak más adatokkal összefüggésben értelmezhető. Éppen ezért a PCO szindróma kivizsgálásában több szakorvos együttműködése szükséges, jellemzően egy belgyógyász-endokrinológus vezetésével.
A PCO kezelése
Bár a PCO szindróma véglegesen egyelőre nem gyógyítható, de életmódváltással szinten tartható az állapot. A nőiesség és termékenység visszanyerése mellett az inzulinrezisztencia késői következményei – cukorbetegség, magas vérnyomás, elhízás – is kivédhetők az egészséges életmóddal, illetve az esetleges gyógyszeres kezeléssel.
A polycystás ovarium (PCO) syndromáról bővebben:
1935−ben a Stein és Leventhal által leírt syndroma (vérzési rendellenességek, ovulatiós zavarok, sub− vagy infertilitas hátterében „nagy fehér ovariumok”) felismerése és annak operatív kezelése (ékresectio) során elért sikerek komoly tudományos eredménynek számítottak. A leírt megfigyelések ma is megállják helyüket, az endokrinológiai szabályozó rendszerek egyre pontosabb megismerésével, azok kölcsönhatásainak feltárásával, a diagnosztikai és terápiás lehetőségek bővülésével azonban az újabban polycystás ovarium (PCO) syndromának nevezett kórkép fogalma új megvilágításba került.
Ma a klinikai megjelenési formák folyamatos spektrumát ismerjük fel. A skála egyik végpontján áll az a sem ciklusanomáliával, sem hirsutismussal, sem acnéval nem rendelkező „beteg”, akinél valamilyen más okból történt ultrahangvizsgálat során polycystás petefészkeket találunk (rá nem mondhatjuk ki a PCO syndroma diagnózisát). A spektrum másik végét a klinikai tünetekkel és a megfelelő laboratóriumi, illetve ultrahangeltérésekkel rendelkező beteg képviseli (Stein és Leventhal leírása ennek a végpontnak felel meg).
Mai ismereteink szerint a polycystás ovarium ultrahangképe egy olyan állapotot tükröz, mely egész életen keresztül fennáll, de a hozzátartozó klinikai megjelenési forma változik. Hogy valaki hol helyezkedik el a skálán, az a genetikai hajlamon túl az életmódtól és leginkább a testtömeg−indextől (body mass index=BMI) függ.
Jellemző példa erre az a normális testsúlyú nő, aki tünetmentes, bár PCO−ja van, ha viszont elhízik, menstruációs zavarok, anovulatio, hirsutismus, acne jelentkezik nála, míg súlyvesztés esetén ezek a tünetek kezelés nélkül visszafordulhatnak.
A PCO syndromáról alkotott képünk a kórélettani kölcsönhatások összetettségén és a klinikai megnyilvánulási formák sokszínűségén kívül a syndroma definíciója, diagnózisa és kezelése körüli viták miatt sem egységes.
A petefészek élettani működésének neuroendokrin szabályozása
A petefészek működésének legfontosabb szabályozója a hypothalamo−hypo physealis rendszer. A hypothalamusban termelődő GnRH a gonadotrop sejtek LH és FSH szekrécióját serkenti. Mind a GnRH, mind a gonadotrop hormonok szekréciója 24 órás ritmust, ezen belül pulzatilis mintát mutat. Az LH serkenti a petefészek szteroidgenesisét és a luteinizációt. Az FSH a folliculus éréséért és az inhibin elválasztás serkentéséért felelős. Mind a szteroid hormonok, mind az inhibin negatív feedback révén gátolja a gonadotrop hormonok szekrécióját. A női szexuálszteroidok egyedülálló sajátossága, hogy a negatív feedback mellett pozitív feedback hatást is kifejtenek. Az érett tüsző által termelt ösztrogén az LH−szekréció hirtelen, nagyfokú emelkedését (LH surge) és ennek következményeként ovulatiót eredményez.
Az utóbbi két évtizedben számos adat látott napvilágot arra vonatkozóan, hogy a petefészek működésének szabályozásában ún. finomszabályozó mechanizmusok is szerepet játszanak. Ezek közé tartozik a helyi és az idegi úton közvetített szabályozás. A petefészek különböző sejtjeiben számos biológiailag aktív anyag (peptidek, neurohormonok, növekedési faktorok, interleukinok, stb.) termelődik. Ezen anyagok egy részéről bebizonyosodott, hogy hatásukat nem az érpályába jutva (tehát nem endokrin úton) fejtik ki, hanem a közvetlen környezetében elhelyezkedő, morfológiailag és funkcionálisan különböző sejteket befolyásolhatja (parakrin hatás) vagy az adott anyagot kiválasztó sejt önmaga működését szabályozhatja (autokrin hatás). A helyi mechanizmusok különösen jelentősek a mind felépítését, mind működését tekintve heterogén és dinamikusan változó petefészekben.
Korábbi, élettani jellegű vizsgálatok indirekt adatokat szolgáltattak arra vonatkozóan, hogy idegpálya létezik a petefészek és az agy között, mely a hypophysistől független, közvetlen idegi szabályozást közvetíthet. A klasszikus neuromorfológiai módszerek korlátai miatt a multisynaptikus pályarendszer kimutatása csak az utóbbi években, a neurotrop vírussal való pályakövetési módszer alkalmazásával vált lehetővé. A vírus petefészekbe történt beadását követően vírussal fertőzött idegsejteket lehetett kimutatni agytörzsi, hypothalamikus és a limbikus rendszerhez tartozó struktúrákban. Ezen agyterületeknek (locus coeruleus, hypothalamus, amygdala) a petefészekműködés szabályozásában játszott élettani szerepét mutatják azok a vizsgálatok, melyek során féloldali sértésüket követően a petefészek működésében változásokat észleltek. A kísérleti eredmények alapján arra is fény derült, hogy bizonyos, a petefészek működését idegi úton szabályozó agyterületek funkcionális aszimmetriát mutatnak.
A chronikus anovulatio
A női reproduktív endokrin szabályozó rendszer megbomlásának egyik első tünete a menstruáció szabálytalanná válása. A szervezet elégtelen endokrin,
parakrin és autokrin működésének vezető tünete a chronikus anovulatio, annak minden tünetével és következményével.
Ennek oka lehet ovarialis (klasszikus Stein−Leventhal syndroma), mellékvese− (androgentermelő tumorok, congenitalis adrenalis hyperplasia, enzymopathiák), és pajzsmirigy− (hypo− vagy hyperthyreosis) eredetű, vagy a szénhidrát−anyagcsere (latens és manifeszt hyperinsulinaemia, periferiás receptor hibák), a központi idegrendszer (GnRH pulzus−frekvencia zavarok, tumor) vagy egyéb szervrendszerek (zsírszövet endokrinológiai aktivitásának változása, enzymopathiák, a leptin termelés rendellenességei, májbetegségek) zavaraira vezethető vissza. A kiváltó ok tartós meglétének egyik tünete a polycystás
ovariumok ultrahangképe.
A chronikus anovulatio következménye lehet a raro−/amenorrhoea, infertilitas, acne, hirsutismus, alopecia, cardiovascularis megbetegedések, diabetes mellitus és
insulinresistentia, továbbá egyes nőgyógyászati malignus daganatok kockázatának növekedése.
Újabb adatok az elhízásról
Az évmilliókon át éhező emberiségnek azon egyedei maradtak fenn, akik kevés táplálékkal is beérték, vagyis „takarékos” génekkel rendelkeztek. Ezek a „takarékos” gének okozzák korunkban – többek között – a bővebb táplálkozással együttjáró világméretű elhízást. A „takarékos” gének közül kiemelendők a béta−1, béta−2, béta−3, a PPAR−gamma, az uncoupling protein−1, a lipoprotein lipáz, a hormonszenzitív lipáz, a leptin és a proopiomelanokortin receptorok génjei.
Az arizonai rezervátumokban élő pima indiánok esete hűen demonstrálja a gének és a környezet egymásra hatását, mivel jelentős elhízásuknak a nyoma sem mutatható ki a mexikói sivatagban élő rokonaikon.
Újabb ismereteink szerint a táplálékfelvétel és az energialeadás számos neuropeptid egymásra hatása következtében alakul ki. Szemléletünk módosult a zsírsejtek szerepét illetően is, mivel róluk ma nemcsak mint energiaraktározó, hanem mint hormontermelő szervrendszerről is gondolkozunk. A citokinek, növekedési, komplement− és alvadási faktorok, a fibrinolytikus rendszer komponensei és egyes lipoproteinek jelentős szerepet töltenek be az elhízást kísérő betegségek létrejöttében. A nagy mennyiségben keringő insulin a leptinre gyakorolt hatásán keresztül, melyet a citokinek (TNF alfa és az interleukin−6, stb.) hatása is segít, növeli a szimpatikus aktivitást és jelentős szerepet játszik a keringési betegségek létrejöttében. Nagy perspektívájú felismerés, hogy a zsírszövet maga is angiotenzinogént és angiotenzin II−t termel. (A 167 aminosavból álló, kizárólag a zsírszövetben termelődő leptint 1994−ben írták le először. Hiánya egerekben obesitást, hyperphagiát, hyperglycaemiát eredményez.
Kövérekben magas, soványokban alacsony koncentrációban van jelen. A serum leptinszintje a zsírraktár aktuális jele az agy és egyéb szövetek felé. Férfiakban a pubertas idején a leptinszint megemelkedik, késői pubertasban, atlétáknál, anorexia nervosában szintje alacsony.)
Az elhízás gyakorisága szerte a világon rohamosan nő. A súlynövekedés mellett jelentős a zsír eloszlása is, hiszen a hasi típusú elhízás sokkal nagyobb kockázatot jelent a kísérő betegségek kialakulására. Sajnos a nők körében is egyre gyakoribb a hasi típusú elhízás. Magyarországi vizsgálatok szerint 42,5%−ban fordul elő a vidéken élő nők között. Fontos a csípőkörfogat mérése is.
A test zsírmennyiségének meghatározására a klinikai kutatómunkában legújabban a DEXA és a multifrekvenciás bioimpedancia módszerek terjedtek el. Az elhízást kísérő betegségek közül a nőket az emlő− és a petefészekrák sújtja, valamint a férfiakhoz képest nagyobb kockázattal kialakuló 2−es típusú cukorbetegség, koszorúérbetegség, magas vérnyomás, visszérbetegségek és térdízületi arthrosis. Az elhízás 2–3−szoros mortalitási kockázatot jelent a normális súlyúakhoz képest. Az elhízással összefüggő daganatos betegségek hazai éves halálozása a nők körében meghaladja a 3000 esetet.
A PCO syndroma és az insulin
A PCO syndromának rövid− és hosszútávú szövődményeit különíthetjük el. A rövidtávú szövődmények közé az anovulatio és következményei, valamint a korai vetélések tartoznak, ezek feltehetően a hyperandrogenismussal függenek össze.
A hosszútávú szövődmények elsősorban a betegséghez társuló anyagcserezavarral hozhatók kapcsolatba, ami nagyon hasonlít a metabolikus X syndromához.
Késői szövődménynek tekinthetjük az endometrium− és petefészek−carcinoma gyakoribb előfordulását is.
A belgyógyászati vonatkozások közül kiemelendő a glukóz−intolerancia (diabetes mellitus és csökkent glukóztolerancia), amely a normál populáció 10%−át, míg a PCO syndromás betegek mintegy 45%−át érinti. A 2−es típusú cukorbetegség a normál populáció 5–6%−át, a PCO syndromás sovány betegek 20%−át, az elhízott PCO syndromás betegek 50–70%−át érinti.
A PCO syndroma kialakulási mechanizmusára született egyik hipotézis szerint a PCO syndromás betegek 70%−ában az insulinreceptor autofoszforilációja károsodott. A jelátvezetési mechanizmus károsodása miatt az insulinhatás csökken, normális mennyiségű insulin subnormális választ vált ki, azaz insulinresistentia alakul ki, amely következményes hyperinsulinaemiát okoz. A magas insulin−koncentráció magas LH−szinttel rendelkező nőkben ovarialis és adrenalis hyperandrogenismust okoz. Az erre genetikailag determinált személyek alacsony sexhormon−kötő globulin szintje és környezeti tényezők egyaránt elősegítik a folyamat kialakulását.
A PCO syndromás nők metabolikus profilja megváltozik, a genetikailag erre determinált betegekben a hyperinsulinaemia miatt 2−es típusú diabetes mellitus, hypertonia, dyslipidaemia, centrális obesitas, haemostasis−változások gyakrabban alakulnak ki, mint az azonos életkorú, de nem PCO syndromás egyénekben.
Ugyanakkor az eddigi vizsgálatok nem igazoltak olyan cardiovascularis eredetű halálozás növekedést, ami kapcsolatba volna hozható a PCO syndromával; az ennek gyanúját felvető vizsgálatok kis esetszámúak voltak.
A PCO syndroma és a hyperandrogen állapotok
A klinikai tapasztalatok alapján a PCO syndroma diagnózisát csak akkor tekinthetjük megalapozottnak, ha a syndroma tüneteivel jelentkező nőkben a hyperandrogenismust okozó egyéb betegségeket kizártuk. Ezek diagnózisa ritka előfordulásuk ellenére azért fontos, mert eltérő kezelést igényelnek. A hyperandrogenismust okozó legfontosabb egyéb betegségek a nem klasszikus 21−hidroxiláz defektus, a Cushing syndroma, az androgéntermelő mellékvese− és petefészekdaganatok, a kortizol−resistentia, valamint a hyperprolactinaemia.
Ezeken kívül a primer hypothyreosis kizárása is ajánlott.
A 21−hidroxiláz defektus a congenitalis adrenalis hyperplasia leggyakoribb formája. A klasszikus (súlyos) és a nem klasszikus (enyhe, későn manifesztálódó) formát a 21−hidroxiláz enzimet kódoló gén (CYP21B) mutációi okozzák. A betegség autosomalis recesszív öröklődésű, PCO syndroma tüneteivel jelentkező nők 2–15%−ában mutatható ki. A nem klasszikus 21−hidroxiláz defektus és a PCO syndroma egymást nagyrészt átfedő tünetei miatt a két betegség klinikai megjelenése megtévesztően hasonló lehet. Az elkülönítést nehezíti, hogy a nem klasszikus 21−hidroxiláz defektusos betegek mintegy 40%−ában a petefészek ultrahang−vizsgálatával PCO−ra jellemző morfológiai elváltozások mutathatók ki. A diagnosztikában napjainkban alkalmazott legeredményesebb és legelterjedtebb módszer a plazma 17−hidroxiprogeszteron meghatározással egybekötött ACTH−stimulációs teszt. Nem klasszikus 21−hidroxiláz defektust bizonyít, ha a plazma normális vagy kissé emelkedett alap 17−hidroxiprogeszteron koncentrációja mellett ACTH adását követően 60 perccel a normálisnál nagyobb 17−hidroxiprogeszteron válasz alakul ki (> 1500 ng/dl). Egyes vizsgálók szerint szűrésre a follikuláris fázisban elvégzett plasma 17−hidroxiprogeszteron vizsgálat is alkalmazható (< 200 ng/dl esetén a betegség valószínűsége alacsony).
A diagnosztikában más hormonvizsgálatok (21−dezoxikortizol), illetve a CYP21B mutáció−analízis is hasznos lehet (típusos mutációk: V281L, P30L). A kórkép kezelésére glukokortikoid készítményeket alkalmazunk.
A Cushing syndroma a glukokortikoidok tartós túltermelése (vagy terápiás adagolása) következményeként kialakuló jellegzetes klinikai tünetegyüttes, melyhez a Cushing syndroma típusától függően androgéntúltermelés társulhat.
Az endogen Cushing syndroma ritka, becsült incidenciája kb. 3,5/millió/év.
Etiológiája többféle, az esetek többségében (mintegy 70%−ában) a hypophysis corticotrop adenomája okozza (Cushing−kór), a mellékvese eredetű és ectopiás ACTH túltermelés következtében előforduló Cushing syndroma ritkább (kb. 15–15%). A Cushing syndroma és a PCO syndroma számos közös tünete (elhízás, magas vérnyomás, csökkent glukóz−tolerancia, hyperandrogenismus, anovulatio, menstruációs zavar) még azokban az esetekben is szükségessé teheti Cushing syndroma kizárását, amikor ultrahangvizsgálattal PCO−ra jellemző elváltozások mutathatók ki. A Cushing syndroma gyanújának kizárására a járóbetegekben is alkalmazható kis dózisú dexamethason teszt és/vagy a 24 órás gyűjtött vizelet kortizol meghatározása, illetve újabban a nyál kortizol vizsgálata javasolt. A Cushing syndroma kezelése az etiológiától függ, általában a sebészi kezelés eredményezhet teljes gyógyulást.
Ritka előfordulásuk ellenére az androgéntermelő petefészek− és mellékvesekéreg−daga natok felismerése a hyperandrogenismus tüneteivel jelentkező nők kivizsgálásának egyik legfontosabb feladata. A daganat által termelt androgének nőkben virilizációt okoznak (hirsutismus, temporális hajhullás, izomtömeg növekedés, mélyülő hang, menses rendellenessége, clitoromegalia). A petefészekben PCO−ra jellemző kép is lehet. A klinikai tünetek általában rövid idő alatt alakulnak ki, gyorsan progrediálnak és súlyosak. Az anamnesis és a fizikális vizsgálat sok esetben nem jelent biztos támpontot az elkülönítésben, a hormonális eltérések viszont gyakran súlyosak, hyperandrogenismusban szenvedő nőkben >200 ng/dl plazma tesztoszteron szint mellékvese− vagy petefészek−daganatot valószínűsít.
Malignus mellékvesekéreg−daganatok esetén gyakran mutatható ki magas dehidroepiandroszteron−szulfát (DHEAS) szint (>700 mg/dl) a plazmában. A differenciáldiagnosztikában elsősorban a dexamethason szuppressziós teszt nyújt segítséget, de a radiológiai képalkotó vizsgálatoknak is fontos szerepük van. A daganatok kezelése elsősorban sebészi.
A kortizol−resistentia igen ritka örökletes betegség, a glukokortikoid receptor zavara okozza. Magas és dexamethasonnal nem (vagy csak részlegesen) szupprimálható plazma kortizol− és androgénszintekkel jár. A klinikai tünetek a defektus súlyosságától függenek. Enyhe esetben a betegség nem okoz tünetet, míg súlyosabb esetben hirsutismus, menstruációs zavar és infertilitas alakul ki. Mineralokortikoid túltermelés tünetei is kifejlődhetnek (hypertonia, hypokalaemia). A tünetek viszonylag nagy adag tartós hatású glukokortikoid készítménnyel enyhíthetők.
Molekuláris biológiai háttér
A PCO syndroma genetikai hátterének vizsgálata új kérdéseket vet fel, ugyanakkor új távlatokat nyithat a betegség diagnosztikájában és kezelésében.
A kórkép pathomechanizmusát illetően a hyperandrogenaemiára és a hyperinsulinaemiára való genetikai hajlam a környezeti tényezőkkel együtt döntő fontosságú. Figyelembe véve, hogy a PCO syndroma egyik legfontosabb következménye az infertilitas, nehéz olyan családokat találni, ahol generációkon keresztül vizsgálható a hibás gének, tünetek felbukkanása. Ugyancsak a potenciális vizsgálati csoport nagyságát csökkenti, hogy a praemenstruumban, valamint postmenopausában lévő vizsgálati személyek nem feltétlenül tesznek eleget a kórkép diagnosztikai kritériumainak. A harmadik problémát a nem eléggé körülhatárolt férfi fenotípus jelenti. Nehézséget jelent továbbá az is, hogy nincs olyan kísérleti állat, melynél hasonló kórkép megtalálható és vizsgálható lenne.
Az elvégzett családfaelemzések döntő többsége autosomalis domináns öröklésmenet mellett foglalt állást. Néhány tanulmány azonban polygénes öröklésmenetet tárt fel. Cytogenetikai vizsgálatok „néhány tanulmány kivételével normális karyotypust igazoltak.
A betegség kialakulásában résztvevő gének feltérképezése során többnyire kapcsoltsági vizsgálatot, valamint egyéb molekuláris genetikai módszert használtak.
A vizsgált géneket négy csoportba sorolhatjuk: a petefészek hormontermelését érintő gének, a szénhidrátanyagcsere, a gonadotropin útvonal génjei, a fő hisztokompatibilitási (HLA) rendszer génjei. A betegség kialakulásával szoros kapcsolatot a CYP11a, CYP17, az insulin – valamint a dopaminreceptor génjének mutációi, polymorphismusai mutatták. A HLA rendszer és a PCO syndroma közötti kapcsolatot a HLA DRW6, HLA DR7, HLA DQA1 0501 gének esetében sikerült igazolni.
A PCO syndroma diagnosztikája
A PCO syndroma diagnózisának változása a vizsgálómódszerek fejlődésével párhuzamosan haladt. Stein és Leventhal eredeti megfigyelését (hirsutismusban, amenorrhoeában, obesitasban szenvedő nők petefészke megnagyobbodott, sok apró kérgi tüszőt tartalmaz), követően az 1970−es évektől a laboratóriumi diagnosztika (radioimmunoassay=RIA) elterjedésével a luteinizáló hormon (LH) és tesztoszteronszintek meghatározásának döntő szerepe lett a diagnózis felállításában. A diagnózis felállításához azonban nemcsak az LH−emelkedésnek kellett jelen lennie, hanem a follikulus stimuláló hormonhoz (FSH) való aránya is meghatározóvá és a diagnózis alapvető feltételévé vált. Kórosnak kezdetben a 2:1 LH/FSH arányt tartották, később ez 3:1−re módosult, azonban számos tanulmány a 2,5:1 arányt tartotta megfelelőnek.
Később az emelkedett arány vesztett jelentőségéből, és az abszolút értékek váltak mérvadóvá. Az össz− és szabad tesztoszteron, valamint a többi androgén meghatározásának kidolgozásával a diagnosztika újabb elemekkel bővült. PCO syndromában emelkedett tesztoszteron−, szabad tesztoszteron−, androsztendion−, LH−, ösztron−, insulinszint, csökkent SHBG szint és emelkedett LH/FSH arány található a normál kontrollokhoz képest. Az androgének önmagukban azonban nem segítenek a diagnózis felállításában, mivel szérumszintjeik csak csekély mértékben és nem minden esetben emelkedettek. A szabad androgén index jobb prediktív értékkel bír, mint a szabad tesztoszteronszint meghatározása, alkalmazásának nagyobb költsége szab gátat.
Az 1980−as években bevezetett ultrahangvizsgálat specificitását és szenzitivitását közel 100%−osnak találták a laparoszkópiával és szövettani vizsgálattal megállapított diagnózishoz képest, így az ultrahang vált a PCO syndroma standard vizsgálómódszerévé. Az 1985−ben Adams és mtsai által a Lancetben leírt kritériumok (10 vagy több, 2–9 mm közötti, a petefészek egy síkjában rendszerint perifériásan elhelyezkedő folliculus, melyek megnagyobbodott, hyperechogén stromát vesznek körül) ma is a PCO syndroma leggyakrabban idézett és használt ultrahang−meghatározását jelentik.
A folliculusok számát és méretét illetően még ma is viták vannak, de az Adams−féle kritériumok kisebb módosításokkal ma is a diagnózis részét képezik.
Diagnosztikus határértékként sem a folliculusok számának 15−re való emelése, sem a folliculusméret 2–5 mm−re szűkítése nem vitt közelebb a diagnózis pontosításához.
A stroma mennyiségét objektivizálni nem könnyű, diagnosztikai kritériumnak általában azt tekintjük, ha a stroma a petefészektérfogat 25%−át elfoglalja. A Dewailly (1994) által az ovarialis stroma mérésére leírt objektív quantitatív módszer alapján ismert, hogy a stroma területe hyperandrogén nőkben nagyobb (és ez a szérum androsztendion koncentrációval korrelál). Amennyiben az ultrahang−diagnózis a folliculusszám alapján nem egyértelmű, a stroma területét Fulghesu (2001) szerint adhatjuk meg (stroma/teljes terület arány >0,34). A stroma hyperthrophiájának megítélése szubjektív és 3D ultrahanggal mérve nem korrelál a biokémiai értékekkel. Az echogenitás függ a készülék beállításától, objektív mérése nem megoldott.
Fontos elkülöníteni a polycystás és a multicystás petefészkeket:
- polycystás ovarium (PCO)
- a felsorolt ultrahangfeltételeknek megfelelő petefészek
- prevalencia 22–23%
- előfordul pubertas előtt gyermekekben, congenitalis adrenalis hyperplasia, hypothyreosis, hyperprolactinaemia és insulinresistens állapotok esetén is
- multicystás ovarium (MCO, MFO)
- stromaterület/teljes terület normális vagy csökkent
- a tüszők mérete >4 mm
- pubertasban, hypothalamicus anovulatióban és a normális menstruációs ciklus korai follicularis fázisában láthatjuk.
A PCO syndroma gyógyszeres kezelése
A PCO syndroma kezelése a beteg aktuális igényének megfelelően a meddőség kezelését, a hyperandrogenaemia tüneteinek visszaszorítását, illetve a PCO syndromára jellemző metabolikus zavar megelőzését és rendezését jelenti.
A meddőség kezelésére gyógyszeres és sebészi ovulatioindukciós módszerek állnak rendelkezésünkre. A gyógyszeres ovulatioindukció során – amennyiben nem kontrollált ovarialis hyperstimulatiót végzünk IVF kezelés keretén belül – célunk a normális, unifollicularis ovulatio helyreállítása, így az ikerterhesség gyakoriságának csökkentése, ugyanakkor az ovarialis hyperstimulatiós syndroma (OHSS) elkerülése.
A sikeres ovulatioindukció céljából elhízás esetén célszerű a gyógyszeres kezelés előtt a testtömeg−index (BMI) csökkentése. A gyógyszeres ovulatioindukció első lépcsője a clomiféncitrát, mivel ez a legegyszerűbb, legveszélytelenebb és egyben legolcsóbb megoldás. A clomifént általában a ciklus 3. vagy 5. napjától adjuk napi 100 mg dózisban. A clomifénnel az irodalmi adatok alapján 80–90%−ban kiváltható az ovulatio, de csak 30–50%−ban következik be terhesség. Ez a discrepantia a clomifén endometriumra és cervixnyákra kifejtett antiösztrogén hatásával, a gyakori korai LH−csúccsal, valamint a be nem következő tüszőrepedéssel magyarázható. Az eredmények javíthatók a ciklus ultrahang−monitorizálásával (folliculometria), hCG adásával ovulatio kiváltása céljából, valamint clomifén és más gyógyszerek (pl. glucocorticoidok, metformin) kombinálásával.
Clomifén−resistentia esetén gonadotrop hormonok adása lehet a következő lépés. Ismert a PCO syndromára jellemző magas LH−szint káros hatása a fertilitásra, így az LH− szintet csökkentő tiszta FSH, illetve rekombináns FSH az elsődlegesen választandó gonadotrop készítmény. Az FSH adás az ún. kisdózisú step−up protokoll szerint javasolt. Ez napi 50–75 IU FSH adását jelenti két hétig, majd a dózist hetenként napi 25–37,5 IU−val növeljük, amíg aktív tüszőnövekedés nem indul meg (tüszőátmérő >10mm). A maximum 35–42 napig tartó kezelés végén, amennyiben 1–3 tüsző átmérője meghaladja a 16 mm−t, 10 000 IU hCG−t adunk az ovulatio kiváltására.
További gyógyszeres ovulatioinductiós lehetőség az insulinérzékenységet fokozó szerek, mint a metformin, troglitazon, vagy rosiglitazon alkalmazása. A kezelés során a PCO syndromára jellemző és a patogenezisben jelentős szerepet játszó hyperinsulinaemiát és insulinresistentiát csökkentjük és így állítjuk helyre a ciklust. A metforminnal történő 16 hetes kezelés 80% körüli ovulatiós és 30–60%−os terhességi arányt eredményez napi 2×500–850 mg dózisban adva. A metformin jól kombinálható clomifénnel, de FSH készítmények és clomifén kombinálása terén az eredmények ellentmondásosak. Az insulinérzékenységet fokozó szerek elsődlegesen választott szerek is lehetnek PCO syndromában ovulatioindukció céljából, amennyiben insulinresistentia igazolható. A metformin magzati malformatiót, károsodást jelenlegi ismereteink szerint nem okoz, de az újszülöttek hosszútávú követése még hiányzik. Nehezíti széleskörű alkalmazását, hogy PCO syndroma kezelésére nem törzskönyvezett.
A PCO syndroma műtéti kezelése
A hagyományos terápia palettáján a mai napig fontos szerepet tölt be a sebészi kezelés. A személyi és tárgyi feltételek megléte esetén a laparoscopos „drilling” különböző módszerei (electrocoagulatio, laser−technika) a követendő eljárások napjainkban.
A petefészkek endocoagulatiójának elvégzésére nincs standard technika, de a jelenlegi tendencia az adhaesiók csökkentése és hatékonyság megtartása céljából a perforációs nyílások számának csökkentése (15–20−ról 3–5−re). Ezzel a módszerrel az összenövések aránya 10% alá csökkenthető. Az irodalmi adatok szerint a felszínes és a mélyebb technikák közel megegyező hatékonyságúak, mégis a legmegfelelőbbnek a 4–5 mm−es operációs mélységet tartjuk.
Az elvégzett műtét után a kóros láncreakció idővel visszaáll, így a beavatkozást a gyermekvállalást megelőző időszakra kell időzíteni. Az ovarium−drilling előnyei a laparoscopia általános előnyei mellett (megterhelés, idő, stb.) a következők:
- Más módon fel nem ismert patológiás elváltozások (endometriosis, adhaesiók) diagnosztizálhatók.
- Az OHSS veszélye csökkenthető, bár későbbi gonadotropin kezelés esetén a túlstimulálás lehetősége nőhet.
- A többes terhesség előfordulása nem nő.
- A korai vetélések száma csökken.
- A műtétet követő gyógyszeres kezelés dózisigénye csökken.
A laparoscopos módszer hatásmechanizmusa az ovariumra korlátozódik:
- A megvastagodott capsula mechanikus roncsolása.
- Az intraovarialis dysregulatio (theca−sejt!) átmeneti felfüggesztése.
- Átmenetileg rendeződhetnek a szabályozó feed−back mechanizmusok és helyreállhat az élettani LH/FSH arány. Jelen ismereteink szerint a műtéti megoldások nincsenek kihatással a PCO syndroma késői következményeire. A tartós utánkövetés és a megfelelő gondozási terv felállítása nélkülözhetetlen.
Onkológiai vonatkozások
Az endometrium−carcinomához vezető hormonális tényezőkről az utóbbi évtizedekben több szerző is beszámolt. Az emelkedett LH−szint következtében nagyobb mennyiségben termelődő androgének (androsztendion, tesztoszteron) nagy része a periférián, tehát a zsírszövetben alakul ösztrogénekké, elsősorban ösztronná. Az emelkedett ösztrogénszint és az anovulatiók miatt csökkent progeszteronszint együttesen vezethetnek endometrium−carcinoma kialakulásához. A carcinogenesis elsődleges triggere az endometriumra gyakorolt, hosszan tartó, kiegyensúlyozatlan ösztrogénhatás. 40 év alatt azonban az endometrium−carcinoma előfordulása igen ritka, mindössze 1–8%−a az összes endometrium−carcinomás esetnek. A kezeletlen ovarialis endocrin dysfunctiók is endometrium−carcinomára hajlamosítanak.
A PCO syndroma és petefészek−carcinoma kapcsolatát feltárva szintén a esettanulmányok jelentették az első lépést. A PCO syndroma relatív kockázatát 2,5−szörösnek találták, és ez a kockázat 10,5−szörös volt azon nők körében, akik életük során soha nem szedtek oralis fogamzásgátló tablettát. A pathogenesisre a magyarázatot az emelkedett LH− és androgén szintek közvetlen epithelialis proliferatív hatásában kereshetjük. A korábban az ovulatioinductiós gyógyszereknek tulajdonított rizikónövekedést a legújabb tanulmányok már nem igazolták.
Az emlőcarcinoma kialakulásában a fokozott ösztrogénhatás is szerepet játszik.
Ennek ellenére a legújabb és legnagyobb esetszámú tanulmányok nem találtak összefüggést a PCO syndroma és emlőrák kialakulása között.
A PCO syndromás betegeknél a malignus daganatok nagy része megelőzhető a részletes kivizsgálással, ezen belül az endometrium−vastagság és a petefészkek rendszeres ultrahangvizsgálatával, a vezető tünetként amenorrhoeát említő betegeknél az endometrium szövettani vizsgálatával. Természetesen elsődleges fontosságú a PCO syndromás betegek megfelelő kezelése. Azon betegek körében, akik terhességet egyelőre nem vállalnak, az oralis fogamzásgátlók szedése kiemelt jelentőségű. A már kialakult petefészek−carcinoma kezelése műtéti, és nem tér el a PCO−syndroma szempontjából negatív anamnesisű betegekétől.
Megállapítások, ajánlások
- A rendelkezésre álló adatok arra utalnak, hogy a petefészekműködés szabályozása jóval öszetettebb folyamat, mint azt korábban feltételeztük. A hypothalamo−hypophysealis rendszer által irányított szabályozó hatások a helyi és az idegi szabályozás révén módosulnak.
- Az elhízás a PCO syndromától függetlenül is jelentős probléma hazánkban. Az elhízás „ára” évi 25 milliárd forintra tehető. Az elhízás mint jelenség visszaszorításához multidiszciplináris összefogás és össztársadalmi aktivitás volna szükséges.
- A glukóz−intolerancia felismerése nőkben felveti a PCO syndroma gyanúját, és fordítva: raro− vagy amenorrhoea, hirsutismus, acne jelentkezése esetén gondolni kell diabetes mellitus lehetőségére.
- Fiatal nőkben nem tartják a hyperandrogenismust cardiovascularis rizikófaktornak, menopausa előtt pedig már csak relatív hyperandroge−nismus igazolható. Vizsgálatok alapján chronikusan nem ovuláló betegeknél csak a menopausa után van egyértelmű növekedés az ischaemiás szív−betegség kockázatában.
- A fellelhető irodalmi adatok, az elvégzett számos tanulmány alapján a PCO syndroma családi halmozódást mutat, kialakulásában több különböző gén játszhat szerepet. Öröklődésmenetét tekintve az eddigi eredmények nem koherensek, a tanulmányok többsége autosomalis domináns öröklésmenetet tart valószínűnek.
- A főként Európában használatos definíció szerint a PCO syndroma a PCO ultrahang jelei + oligo/amenorrhoea és/vagy a hyperandrogenaemia klinikai jelei (hirsutismus vagy acne) együttes jelenlétét jelenti. A főként Észak−Amerikában használt meghatározás szerint a diagnózishoz a PCO ultrahangképétől függetlenül bizonyítani kell a hyperandrogenismust (biokémiai és/vagy klinikai módszerrel) és az ovarialis dysfunkciót (chronikus anovulatio). Nem mondható ki a PCO syndroma diagnózisa azokra, akik a PCO ultrahangképével rendelkeznek, de tünetmentesek és nincs biokémiai elváltozásuk. Klinikai tünetekkel jelentkezők esetén végezzünk ultrahangvizsgálatot, polycystás ovariumok esetén kimondhatjuk a syndroma diagnózisát. Amennyiben az ultrahanglelet negatív, az emelkedett LH, tesztoszteron vagy szabad androgén index, illetve az éhomi glukóz: insulin arány megadja a diagnózist.
- A gyógyszeres kezelés az ovulatioindukciós protokollok alkalmazását jelenti. Újabban hozzáférhető az insulinérzékenységet fokozó metformin gyógyszer is. Széleskörű alkalmazását nehezíti, hogy PCO syndroma kezelésére nem törzskönyvezett. Ugyanakkor, ha figyelembe vesszük a részletes kivizsgálás klinikai szintű igényességét, insulinresistentia esetén alkalmazható (rendelhetősége nem kötött belgyógyászati szakvizsgához).
- A laparoscopos drillingnek helye van a terápiás palettán, a lépcsőzetesen felépített indukciós kezelések kiegészítő eljárásaként. A laparoscopia térhódítása ellenére természetesen napjainkban sem tiltott laparotomia útján petefészek−ékresectiót végezni. A diagnózis felállításakor a lehetséges késői szövődmények megelőzése érdekében a beteget kezelésben kell részesíteni: amennyiben terhességet az adott időben nem szeretne vállalni, oralis fogamzásgátló készítmény adása javasolt, terhesség elérése céljából gyógyszeres ovulatioindukció szükséges, ennek eredménytelensége vagy társjavallat fennállása esetén műtéti megoldás ajánlott.
- A PCO syndromával járó megváltozott endokrin miliő hajlamosíthat endometrium−, illetve petefészek−carcinoma kialakulására, kérdéses azonban összefüggése az emlőcarcinomával. A PCO syndromás betegek között háromszor nagyobb az esély endometrium−carcinoma kialakulására az átlagpopulációhoz képest. Endometrium−carcinoma esetén a kiegyensúlyozatlan ösztrogénhatás, petefészekrák esetén az emelkedett LH− és androgénszintek lehetnek a felelősek a fokozott proliferációért. A syndroma kezelésén túl a rendszeres ultrahangellenőrzés feltétlenül indokolt.
- Ma a polycystás ovarium syndroma nem egyszerűen nőgyógyászati betegségnek, hanem több szervrendszert érintő endocrinopathiának tekintendő, amit mind kivizsgálása, mind kezelése során figyelembe kell venni. A beteg optimális ellátása nőgyógyász, belgyógyász és endokrinológus együttműködésével valósítható meg.